Substâncias simples e compostas
Substâncias simples são formadas por apenas um elemento químico; já quando se tem dois ou mais elementos na composição, as substâncias são compostas.
O estudo das reações químicas de decomposição foram importantes no desenvolvimento da Química, pois permitiram classificar as substâncias.
Cientistas observaram que nem todas as substâncias poderiam ser decompostas e, por isso, utilizaram essa observação para determinar se as substâncias puras eram simples ou compostas.
Para eles, as substâncias compostas se dividiam dando origem a novas substâncias, enquanto que substâncias simples não sofriam decomposição.
Embora esse conceito hoje não seja mais aceito, as investigações realizadas nessa área foram importantes para o avanço da Ciência.
Substâncias simples
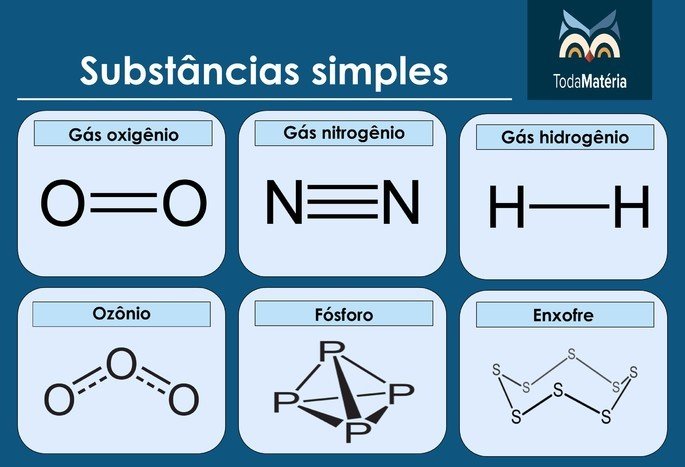
As substâncias simples são formadas por apenas um elemento químico, mas a maneira como os átomos se organizam para produzi-las pode variar da seguinte forma:
- Há átomos que permanecem isolados.
- Há átomos que se agrupam de modos distintos e podem formam diferentes substâncias.
Exemplo:
| Átomo isolado | Mais de um átomo | |
|---|---|---|
| He | O2 | O3 |
| O hélio que representa tanto o elemento químico quanto uma molécula de hélio. | A junção de dois átomos de oxigênio forma o oxigênio molecular e a união de três átomos forma a molécula de ozônio. | |
Atomicidade
O número de átomos existentes em uma substância simples representa a sua atomicidade. Sendo assim, tem-se a seguinte classificação:
- Moléculas monoatômicas: formadas por apenas um átomo.
- Moléculas diatômicas: formadas por dois átomos.
- Moléculas triatômicas: formadas por três átomos.
Exemplos de substâncias simples
Substâncias compostas
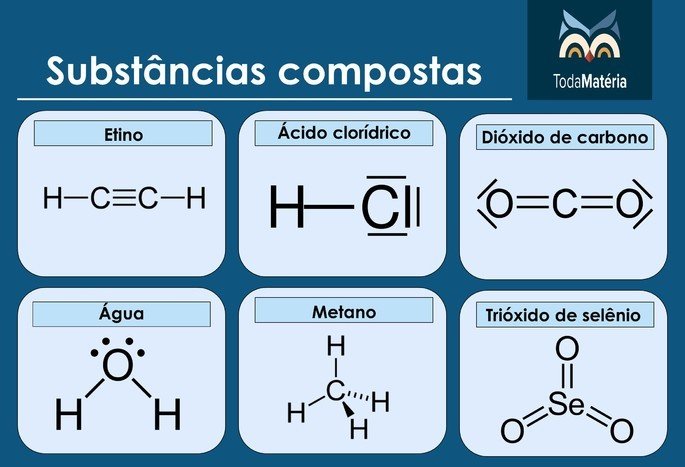
As substâncias compostas também são chamadas de compostos químicos, que são formados em reações químicas por átomos ou íons de diferentes elementos.
Exemplo:
| Átomos | Íons |
|---|---|
| Duas substâncias simples (N2 e H2) reagem e formam uma substância composta (NH3). | Um cátion (Na+) e um ânion (Cl-) reagem e formam uma substância composta (NaCl). |
Assim como ocorre com as substâncias simples, os compostos químicos podem ser formados por átomos em proporções diferentes.
É o que ocorre com a água (H2O) e o peróxido de hidrogênio (H2O2). Ambos são formados apenas por hidrogênio e oxigênio, mas a quantidade de átomos nas substâncias são diferentes e, por isso, fazem com que esses compostos sejam distintos.
Exemplos de substâncias compostas
Substâncias puras e misturas
Uma substância pura é formada por um único tipo de espécie química, ou seja, sua composição e propriedades são fixas. Uma mistura contém mais de um tipo de componente e, por isso, sua organização é variável.
Dessa forma, só podemos distinguir uma substância pura de uma mistura ao conhecermos sua composição.
Ao compararmos um copo com água e um copo com açúcar dissolvido, nossos olhos não percebem nenhuma diferença. Entretanto, se ingerirmos o conteúdo dos dois copos notaremos que um é a substância pura e o outro é constituído de uma mistura.
Substâncias puras
Uma substância pura é o conjunto de apenas uma espécie química, ou seja, ela não está misturada com outras.
Vamos utilizar a água como exemplo. A água (H2O) é reconhecida por suas características e as propriedades específicas desse material nos ajudam a identificá-lo. As principais propriedades da água são:
| Densidade | 1,00 g/cm3 |
|---|---|
| Ponto de fusão | 0 ºC |
| Ponto de ebulição | 100 ºC |
Quando um material possui propriedades fixas e invariáveis em toda a sua extensão, dizemos que se trata de uma substância pura.
Ao colocarmos sal de cozinha, o cloreto de sódio (NaCl), dentro de um copo com água e mexermos ocorrerá uma mudança.
O resultado é um produto com densidade intermediária entre a da água e do sal. Isso ocorre porque a água deixou de ser uma substância pura e se tornou uma mistura.
Ao tentar congelar essa mistura, você perceberá que a temperatura de fusão será menor que 0 ºC e que também essa mistura não entrará em ebulição à 100 ºC, mais calor será necessário para evaporar esse produto.
Substâncias puras simples e compostas
As substâncias puras são classificadas como simples quando em sua composição há átomos de apenas um elemento químico.
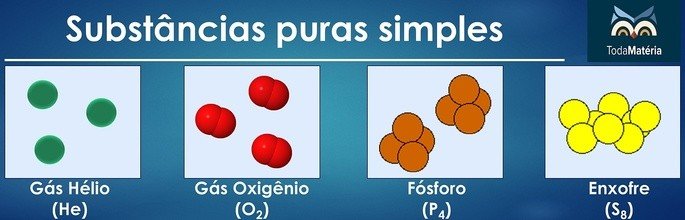
O arranjo de átomos de dois ou mais elementos químicos formam as substâncias puras compostas.

Misturas
Uma mistura corresponde a junção de duas ou mais substâncias puras, que são chamadas de componentes.
Ao contrário das substâncias puras, suas propriedades não são fixas, pois dependem da proporção dos componentes na mistura.
Veja como a densidade, uma propriedade física, varia conforme a quantidade de sal misturado com a água.
| Porcentagem de sal na massa total da mistura | Densidade da mistura (g/cm3) a 20 °C |
|---|---|
| 1 | 1,005 |
| 8 | 1,056 |
| 12 | 1,086 |
| 16 | 1,116 |
| 26 | 1,197 |
Sendo assim, a adição de água e sal, em qualquer proporção, possui densidade variável e, por isso, não podemos classificar a mistura nem como água nem como sal.
Misturas homogêneas e heterogêneas
Misturas homogêneas são aquelas que apresentam os componentes em apenas uma fase e, por isso, as mesmas propriedades em todos os seus pontos.
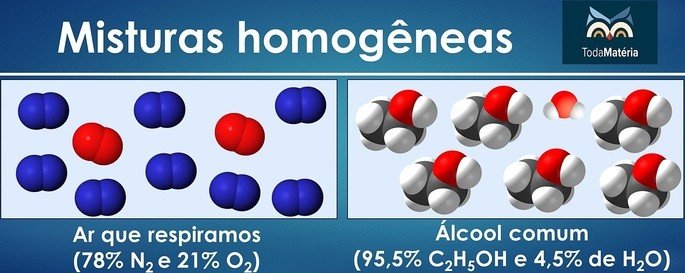
Quando visualmente percebemos mais de uma fase, então a mistura é classificada como heterogênea.

Resumo sobre substâncias puras e misturas
| Substâncias puras e misturas | ||
|---|---|---|
Sistema homogêneo
(apenas uma fase)
|
Substância pura
(um só componente)
| |
Mistura homogênea
(mais de um componente na mesma fase)
| ||
Sistema heterogêneo
(mais de uma fase)
|
Substância pura
(um componente em diferentes estados físicos)
| |
Mistura heterogênea
(mais de um componente em mais de uma fase)
| ||
As misturas podem ser homogêneas ou heterogêneas. Elas são formadas por duas ou mais substâncias e o que as distingue é o fato de serem ou não perceptíveis.
Misturas Homogêneas
São aquelas em que não se consegue perceber a diferença entre duas ou mais substâncias.
Elas apresentam-se de forma uniforme, em apenas uma fase (monofásica). Isso acontece porque as substâncias se dissolvem e se tornam, na verdade, uma solução.
Exemplos:
- copo de água com açúcar - mistura homogênea líquida
- cadeado de latão (embora não se consiga ver, o latão é feito a partir de uma mistura entre cobre e zinco) - mistura homogênea sólida
- ar - mistura homogênea gasosa
Misturas Heterogêneas
O mesmo não acontece com as Misturas Heterogêneas. Neste caso é nítida a presença de duas ou mais substâncias numa mistura. Apresenta duas ou mais fases (polifásica).
Exemplos:
- água com óleo - mistura heterogênea líquida
- ouro e areia - mistura heterogênea sólida
Não existem misturas heterogêneas gasosas.
Misturas Coloidais
Há, ainda, outro tipo de misturas: as chamadas misturas coloidais.
Embora pareçam ser homogêneas, pois a diferença entre as misturas não é perceptível, essas misturas são heterogêneas. Isso porque essa diferença se torna clara através da utilização de instrumentos.
Exemplos:
- o sangue: aparentemente homogêneo, através do microscópio é possível verificar que o mesmo é composto por glóbulos, plaquetas e plasma.
- o leite: também com aparência uniforme, o leite é composto por água, gordura, proteínas, entre outros, os quais somente podem ser vistos mediante análise laboratorial.
As misturas coloidais são um tipo de mistura heterogênea cuja diferença entre as misturas não é perceptível a olho nu.
Métodos de Separação de Misturas
Há várias formas de separar misturas heterogêneas, dentre as quais a catação. A catação é um tipo de separação de mistura manual, cujo exemplo mais comum é a retirada de impurezas dos alimentos, tal como cotidianamente fazemos antes de preparar arroz.
Métodos de separação de misturas heterogêneas:
- Centrifugação
- Decantação, dissolução fracionada
- Filtração, flotação
- Separação magnética
- Levigação
- Peneiração
- Ventilação
As misturas homogêneas, por sua vez, têm de passar por processos químicos. Os principais deles são: destilação simples e destilação fracionada.
O mesmo acontece com as misturas coloidais. Estas, obrigatoriamente, tem de ser separadas por processos químicos.
Referência:


Nenhum comentário:
Postar um comentário